全球首款CD7-CAR-T療法再破壁壘,兒童及青少年T細胞腫瘤治療迎來新希望
發布日期:2025-12-05 瀏覽次數:1361
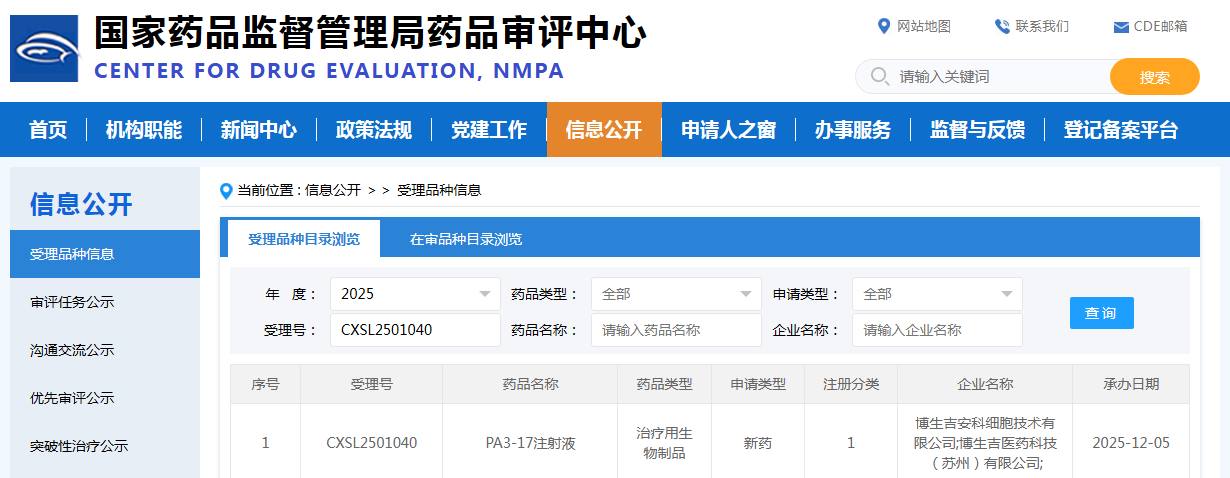
2025年12月5日,安徽安科生物工程(集團)股份有限公司參股公司博生吉安科細胞技術有限公司宣布,其全球首創的靶向CD7的自體CAR-T細胞產品PA3-17注射液,針對兒童及青少年復發/難治性T淋巴母細胞白血病/淋巴瘤(R/R T-ALL/LBL)的新適應癥臨床試驗申請(IND),已正式獲得國家藥品監督管理局藥品審評中心(CDE)受理(受理號:CXSL2501040)。此舉標志著PA3-17注射液在成人適應癥基礎上,正式進軍兒童青少年高危患者群體,有望改寫我國T細胞惡性腫瘤的治療格局。
作為被國家藥品監督管理局藥品審評中心(CDE)納入“突破性治療品種”的產品,PA3-17注射液已進入成人R/R T-ALL/LBL關鍵II期臨床試驗階段并展現出卓越潛力,I期注冊臨床試驗客觀緩解率(ORR)高達85%,MRD陰性完全緩解率更是高達95%,療效與安全性雙優。此次兒童適應癥的快速推進,不僅彰顯博生吉技術平臺的領先實力,更預示著我國在CAR-T療法自主創新上邁出關鍵一步。
PA3-17憑借其非基因編輯的技術路徑,成功攻克了CAR-T療法中T細胞“自相殘殺”的行業難題,并于2021年8月獲臨床試驗批準,成為全球該靶點自體CAR-T研發的重要突破。該產品已相繼獲得美國FDA與歐盟EC的孤兒藥認定,國際化布局穩步推進。作為合作方,安科生物正全力協同推動該產品的商業化進程,致力于早日實現其臨床價值與市場價值。
此次PA3-17兒童/青少年適應癥的IND受理,不僅是博生吉的重要里程碑,也是中國創新藥在細胞治療領域邁向全球的重要一步。安科生物將全力支持其臨床推進與商業化準備,共同期待這一療法早日為更多患兒家庭帶來希望。

2025年12月5日,安徽安科生物工程(集團)股份有限公司參股公司博生吉安科細胞技術有限公司宣布,其全球首創的靶向CD7的自體CAR-T細胞產品PA3-17注射液,針對兒童及青少年復發/難治性T淋巴母細胞白血病/淋巴瘤(R/R T-ALL/LBL)的新適應癥臨床試驗申請(IND),已正式獲得國家藥品監督管理局藥品審評中心(CDE)受理(受理號:CXSL2501040)。此舉標志著PA3-17注射液在成人適應癥基礎上,正式進軍兒童青少年高危患者群體,有望改寫我國T細胞惡性腫瘤的治療格局。
作為被國家藥品監督管理局藥品審評中心(CDE)納入“突破性治療品種”的產品,PA3-17注射液已進入成人R/R T-ALL/LBL關鍵II期臨床試驗階段并展現出卓越潛力,I期注冊臨床試驗客觀緩解率(ORR)高達85%,MRD陰性完全緩解率更是高達95%,療效與安全性雙優。此次兒童適應癥的快速推進,不僅彰顯博生吉技術平臺的領先實力,更預示著我國在CAR-T療法自主創新上邁出關鍵一步。
PA3-17憑借其非基因編輯的技術路徑,成功攻克了CAR-T療法中T細胞“自相殘殺”的行業難題,并于2021年8月獲臨床試驗批準,成為全球該靶點自體CAR-T研發的重要突破。該產品已相繼獲得美國FDA與歐盟EC的孤兒藥認定,國際化布局穩步推進。作為合作方,安科生物正全力協同推動該產品的商業化進程,致力于早日實現其臨床價值與市場價值。
此次PA3-17兒童/青少年適應癥的IND受理,不僅是博生吉的重要里程碑,也是中國創新藥在細胞治療領域邁向全球的重要一步。安科生物將全力支持其臨床推進與商業化準備,共同期待這一療法早日為更多患兒家庭帶來希望。
















